
产品货号:
WH0203
中文名称:
DNA文库构建试剂盒(illumina平台)
英文名称:
DNA Library DirectFast Construction Kit(illumina)
产品规格:
24次|96次
发货周期:
1~3天
产品价格:
询价
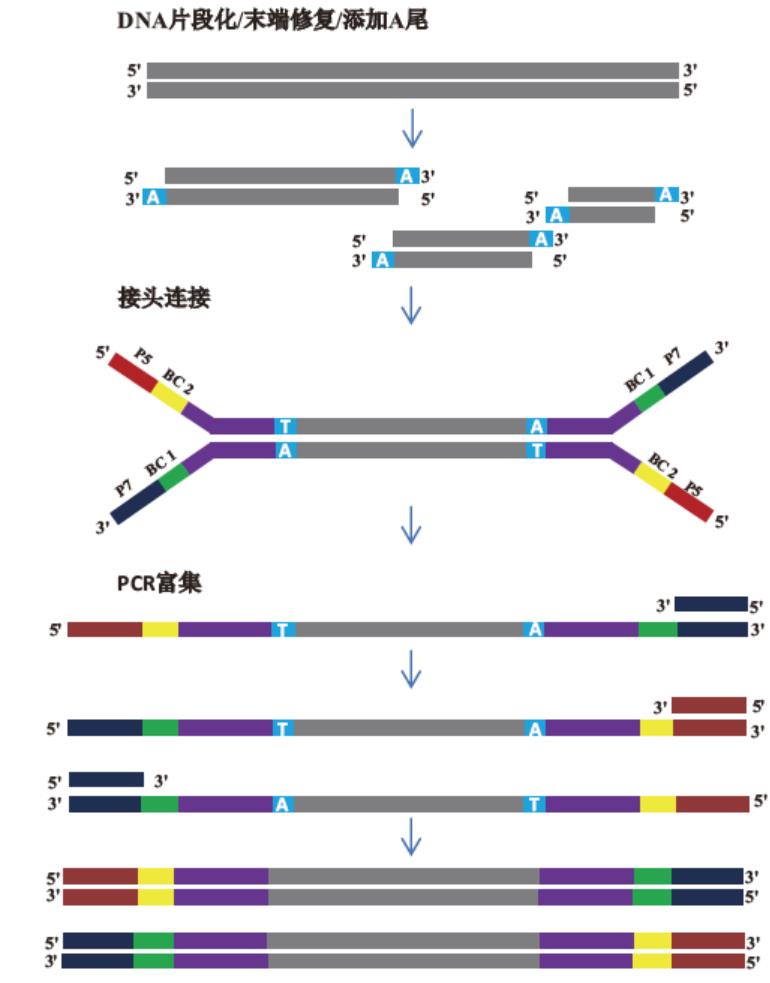
本试剂盒是专门针对于illumina高通量测序平台所优化的DNA文库构建试剂盒。本制品可将经超声处理、化学处理、酶处理的片段化双链DNA或小片段DNA的末端修复和3'端dA尾添加在一管内一步法完成,同时所得产物无需纯化,可直接用于adapter的连接。

适用于illumina高通量测序平台DNA文库构建。适用样本量:1ng~1μg DNA。

- DNA片段化过程和PCR富集过程不存在碱基偏好性,测序均一度好。
- 高文库转化效率,DNA样本起始量可低至1ng。
- 一管式酶促反应,操作简便,省去多步纯化步骤,整个建库流程仅需2.5小时。

| 组分 | 24次 | 96次 |
| 5×FEA Enzyme Mix | 240μL | 960μL |
| 10×FEA Reaction Buffer | 120μL | 480μL |
| FEA Enhancer | 120μL | 480μL |
| BalbSeq DNA Ligase | 240μL | 960μL |
| 5×Ligation Buffer | 500μL | 2×1mL |
| 2×HiFi PCR MasterMix | 600μL | 4×600μL |
| P5/P7 Primers Mix(10μM each) | 120μL | 480μL |
| Nuclease-Free ddH2O | 1mL | 4×1mL |
保存:-20℃,避免反复冻融,有效期1年。




单索引接头(Illumina,货号:WH0206)
DNA分选纯化磁珠(货号:WH0199)

- 操作过程请注意避免核酸样品和产物之间的交叉感染。
- 请使用不含RNase和DNase的枪头、EP管进行试验。
- 试验开始前,请清洁操作台,并使用RNase及DNA清除试剂(如RNase Away)处理台面。确保没有RNase和DNA污染。
- 进行文库扩增前,请确保PCR仪已经调试好并处于稳定的状态。
- 试验前请仔细阅读说明书,如果需要暂停试验,或者无需立即进行下游试验。可根据说明书推荐将试验产物保存于-20℃并安排后续试验。
- 由于使用本制品所进行的片段化过程为酶促反应,故片段化过程对反应温度、反应时间、体系配制以及DNA上样量等因素较为敏感。强烈推荐用户按照本说明书所述步骤及优化的反应参数(如反应时间等)进行试验。

一、片段化/末端修复/A尾添加
- 试验准备:
- 在开始试验前,需要明确核酸的浓度以及DNA需溶解于哪种溶剂中。
注:确定上样DNA浓度至关重要,尤其在上样量低于100ng时。推荐使用Qubit、Picogreen或者其他染料法对DNA浓度进行准确定量。另外,请确认DNA溶于哪种溶剂,溶剂不同,则采用的处理方式也略有不同。 - 将各试剂置于冰上,5×FEA enzyme Mix融化后用手指轻弹后混匀,不要涡旋。其余试剂可短暂涡旋混匀。
- 在开始试验前,需要明确核酸的浓度以及DNA需溶解于哪种溶剂中。
- 试验步骤:
- 当DNA溶解于去离子水、10mM Tris、Buffer EB或0.1×TE中,请使用如下步骤进行片段化/末端修复/A尾添加反应。
- 按下表设置PCR仪反应程序。开启热盖,热盖温度设置为70℃。
注:确切的片段化反应时间需要根据DNA的实际上样量进行优化。下面表1中列出了10ng、100ng和1000ng上样量DNA片段化所需的时间,用户可以参照此时间调整自己的实验。调整过程中,我们推荐额外设置一个反应时间延长3min以及一个缩短3min的对照。这样有助于确定切割至所需片段大小时所需要的准确反应时间。关于片段化时长的更多建议,请参考我司产品DNA片段化/末端修复/加dA尾试剂(Illumina)(货号:WH0208)说明书。反应步骤 反应温度 反应时间 1 4℃ 1min 2 32℃ 3~24min 3 65℃ 30min 4 4℃ 保持
表1.片段化时间选择表DNA主峰大小 片段化时间(min)(32℃) 250bp 350bp 450bp 550bp 10ng DNA上样量 24 16 14 10 100ng DNA上样量 16 10 8 6 1000ng DNA上样量 14 8 6 4 - 请按下表配制反应体系,冰上操作,各成分加入后,请轻柔吸打混匀,注意不要涡旋。
注:对于多个反应,请计算所需试剂的总体系并在此基础上增加体系10%,以避免因溶液转移过程中因挂壁损失而造成分装反应数不足的问题。成分 用量 DNA上样量≥10ng DNA上样量<10ng 10×FEA Reaction Buffer 5 5μL DNA样本 X X μL FEA Enhancer 0 2.5μL Nuclease-Free ddH2O (35-X)μL (32.5-X)μL 总体积 40μL 40μL - 取1个新的200μL薄壁管置于冰上,向管中加入10μL 5×FEA Enzyme Mix,随后将步骤b中反应体系转移40μL至同一薄壁管中,轻柔吸打混匀10次。
- 瞬时离心薄壁管,立刻置于已预冷至4℃的PCR仪中,并启动反应程序。
- 当反应程序结束后,将薄壁管从PCR仪中取出并置于冰上。
- 立即进入接头连接步骤。
- 按下表设置PCR仪反应程序。开启热盖,热盖温度设置为70℃。
- 当DNA溶解于1×TE溶液中时,请参照以下步骤进行DNA的片段化/末端修复/A尾添加反应。
- 按下表设置PCR仪反应程序。开启热盖,热盖温度设置为70℃。
注:反应时间需根据DNA的实际上样量进行优化。若DNA上样量≥10ng,反应体系中加入2.5μL FEA Enhancer,推荐使用25min作为起始反应时间,此时产生的片段主要集中于300~500bp;若DNA上样量<10ng,反应体系中加入5μL FEA Enhancer,则推荐使用15min作为起始时间,此时片段集中于300bp。若需要进行调整,则请以3min为单位,在原反应时间基础上进行增减,直至得到所需要的片段大小。反应步骤 反应温度 反应时间 1 4℃ 1min 2 32℃ 5~35min 3 65℃ 30min 4 4℃ 保持 - 请按下表配制反应体系,冰上操作,各成分加入后,请轻柔吸打混匀,注意不要涡旋。
注:对于多个反应,请计算所需试剂的总体系并在此基础上增加体系10%,以避免溶液转移过程中因挂壁损失而造成分装反应数不足的问题。成分 用量(μL) DNA上样量≥10ng DNA上样量<10ng 10×FEA Reaction Buffer 5 5 DNA样本 X X FEA Enhancer 2.5 5 Nuclease-Free ddH2O (32.5-X) (30-X) 总体积 40 40 - 取1个新的200μL薄壁管置于冰上,向管中加入10μL 5×FEA Enzyme Mix,随后将步骤b中反应体系转移40μL至同—薄壁管中,轻柔吸打混匀10次。
- 瞬时离心薄壁管,立刻置于已预冷至4℃的PCR仪中,并启动反应程序。
- 当反应程序结束后,将薄壁管从PCR仪中取出并置于冰上。
- 立即进入接头连接步骤。
- 按下表设置PCR仪反应程序。开启热盖,热盖温度设置为70℃。
- 当DNA溶解于其他溶液中时,请确定溶液中的盐离子,尤其EDTA的浓度。EDTA对反应影响较大,如果不确定溶液中EDTA浓度或EDTA浓度较高,推荐使用DNA分选纯化磁珠(货号:WH0199)对DNA进行纯化。纯化步骤如下:
- 将磁珠置于室温平衡20min。
- 若DNA溶液体积<50μL,请用无核酸酶的去离子水补足体积至50μL。
- 加入1.8×体积(90μL)完全涡旋混匀的磁珠至DNA溶液中,吸打混匀10次。若DNA溶液体积大于50μL,请根据DNA溶液的实际体积,加入1.8×体积完全涡旋混匀的磁珠。
- 室温孵育5min后,将反应管置于磁力架上5min。待磁珠完全贴壁后,用移液器小心吸弃上清。
- 将反应管置于磁力架上,用200~500μL (没过磁珠即可) 80%乙醇(现用现配)洗涤磁珠,用移液器轻轻吹打3~5次(不要吹散磁珠)。磁力架上静置30sec后,用移液器小心吸弃上清。
- 重复此洗涤步骤一次。
- 将反应管置于磁力架上,打开离心管盖于室温条件下晾置5~10min或至磁珠干燥为止。
注:不要过分干燥磁珠,否则会降低得率。 - 将PCR管从磁力架中取出,加入32.5μL 10mM Tris-HCl (pH8.0)进行洗脱,使用移液器吹打充分混匀10次。室温静置5min后,置于磁力架上5min,待磁珠完全贴壁后,转移约30μL上清至新的离心管中。
- 使用Quibit、Picogreen或其他荧光定量方法测定纯化后的DNA浓度。
- 将磁珠置于室温平衡20min。
- 当DNA溶解于去离子水、10mM Tris、Buffer EB或0.1×TE中,请使用如下步骤进行片段化/末端修复/A尾添加反应。
二、接头连接
将各试剂置于冰上,BalbSeq DNA Ligase融化后用手指轻弹混匀,不要涡旋。其余试剂可短暂涡旋混匀。
- 片段化/末端修复/A尾添加反应结束以后,向此50μL反应体系中加入Y μL的adapter溶液,轻柔吸打混匀后置于冰上。
注:本试剂盒中不含测序DNA adapter,请参考接头供应商提供的使用条件。推荐使用单索引接头(Illumina)(货号:WH0206),为了达到较高的连接效率,我们推荐反应体系中DNA片段与adapter的摩尔比在1:200至1:10之间。 - 按照下表所示各成分用量配制反应体系,并将配制完成的反应体系轻柔混匀后置于冰上。
成分 用量 5×ligation Buffer 20μL BalbSeq DNA Ligase 10μL Nuclease-Free ddH20 (20-Y)μL 总体积 (50-Y)μL - 将此配制好的(50-Y)μL连接反应液加入至第1步准备的反应液中,轻柔吸打混匀10次后置于预设温度为20℃的金属浴或PCR仪中反应15min。
注:此步骤如果使用PCR仪进行反应,PCR仪热盖温度设定为≤40℃。 - 接头连接产物的纯化推荐使用DNA分选纯化磁珠(货号:WH0199),向反应产物中加入1×体积(100μL)磁珠进行纯化,具体步骤如下:
- 将磁珠置于室温平衡20min。
- 涡旋使磁珠充分悬浮,加入100μL磁珠至步骤3连接产物中,充分吸打混匀10次。
- 室温孵育5min后,将反应管置于磁力架上5min。待磁珠完全贴壁后,用移液器吸弃上清。
- 将反应管置于磁力架上,用200~500μL (没过磁珠即可) 80%乙醇(现用现配)洗涤磁珠,用移液器轻轻吹打3~5次(不要吹散磁珠)。磁力架上静置30sec后,用移液器小心吸弃上清。
- 重复此洗涤步骤—次。
- 将反应管置于磁力架上,打开离心管盖于室温条件下晾置5~10min或至磁珠干燥为止。
注:不要过分干燥磁珠,否则会造成得率降低。 - 将PCR管从磁力架中取出,加入22.5μL 10mM Tris-HCl (pH8.0)进行洗脱,使用移液器吹打充分混匀10次。室温静置5min后,置于磁力架上5min,待磁珠完全贴壁后,转移约20μL上清至新的离心管中,用于后续的PCR富集实验。
注:如果连接产物无需进行PCR富集,可在步骤g中加入12.5μL的10mM Tris-HCl(pH8.0)洗脱DNA,并转移10μL纯化后的DNA用于后续的试验反应。如不立即使用,请将样品冻存于-20℃保存。 - 如进行DNA长度分选,加入102.5μL无核酸酶去离子水进行洗脱。并转移约100μL上清至新的离心管中,用于后续的DNA片段长度分选。
- 将磁珠置于室温平衡20min。
- DNA长度片段分选操作步骤:DNA长度片段分选操作步骤:DNA片段长度的分选推荐使用DNA分选纯化磁珠(货号:WH0199),请参考表2中两步筛选过程中的磁珠添加比例进行操作。如果使用其它磁珠,请按照磁珠说明书推荐的分选比例进行操作。
表2.片段分选推荐磁珠用量
以插入片段大小为250bp的情况为例,使用磁珠进行纯化,具体步骤如下:文库参数 磁珠添加比例 初始片段大小 连接接头后
片段大小第一次
筛选比例第二次
筛选比例250bp 370bp 0.6× 0.1× 300bp 420bp 0.55× 0.1× 350bp 470bp 0.53× 0.1× 400bp 520bp 0.5× 0.1× 450bp 570bp 0.47× 0.1× 500bp 620bp 0.45× 0.1× - 将磁珠置于室温平衡20min。
- 涡旋使磁珠充分悬浮,按表2第一次筛选比例加入0.6×体积(60μL)磁珠至100μL纯化体系中,充分吸打混匀10次。
- 室温孵育5min后,将反应管置于磁力架上5min。待磁珠完全贴壁后,用移液器小心转移上清液至一个新的含有0.1×体积(10μ1)磁珠的离心管中并立即吹打混匀至少10次。转移上清时注意不要吸到磁珠。
- 室温孵育5min后,将反应管置于磁力架上5min。待磁珠完全贴壁后,用移液器吸弃上清。
- 将反应管置于磁力架上,用200~500μL (没过磁珠即可) 80%乙醇(现用现配)洗涤磁珠,用移液器轻轻吹打3~5次(不要吹散磁珠)。磁力架上静置30sec后,用移液器小心吸弃上清。
- 重复此洗涤步骤一次。
- 将反应管置于磁力架上,打开离心管盖于室温条件下晾置5~10min或至磁珠干燥为止。
注:不要过分干燥磁珠,否则会降低得率。 - 将PCR管从磁力架中取出,加入22.5μL 10mM Tris-HCl (pH8.0)进行洗脱,使用移液器吹打充分混匀10次。室温静置5min后,置于磁力架上5min,待磁珠完全贴壁后,转移约20μL上清至新的离心管中,用于后续的PCR富集实验。
- 将磁珠置于室温平衡20min。
三、库PCR宫集
- 将2×HiFi PCR MasterMix和P5/P7 Primers Mix (10μM each)置于冰上融化,2×HiFi PCR MasterMix轻弹颠倒混匀,P5/P7 Primers Mix (10μM each)可短暂涡旋混匀。
- 按下表设置PCR仪反应程序,开启热盖,温度设置于105℃。
注:请根据DNA的质量和上样量确定PCR循环数。一般而言,对于100ng、10ng、1ng文库起始DNA,在进行PCR富集时分别需要扩增6、10、12个循环。如果在PCR富集之前经过片段大小分选步骤(size-selection),则建议在原有基础上再增加2~4个循环;如果DNA质量较差(比如提取FFPE样品),建议在原有基础上再增加1~3个循环。步骤 温度 时间 循环数 1 98℃ 2min 1 2 98℃ 20sec 6~12 3 60℃ 30sec 4 72℃ 30sec 5 72℃ 1min 1 6 4℃ 保持温度 1 - 按照下表配制PCR体系,注意此步骤需于冰浴中操作。
成分 用量 2×HiFi PCR MasterMix 25μL P5/P7 Primers Mix(10μM each) 5μL 总体积 30μL - 将纯化后的带有adapter的文库连接产物20μL转移至PCR管中,加入30μL步骤3中配制好的PCR反应液,轻柔吸打10次混匀。
注:配制反应体系时,请全程将反应管置于冰上进行操作。 - 瞬时离心后将PCR反应管置于PCR仪内,按步骤2反应程序进行扩增。
- 当PCR样品温度降至4℃,将PCR产物取出并使用1×体积(50μL)DNA分选纯化磁珠(货号:WH0199)进行纯化。
- 将磁珠置于室温平衡20min。
- 涡旋使磁珠充分悬浮,加入50μL磁珠至PCR产物中,充分吸打混匀10次。
- 室温孵育5min后,将反应管置于磁力架上5min。待磁珠完全贴壁后,用移液器小心吸弃上清。
- 将反应管置于磁力架上,用200~500μL (没过磁珠即可) 80%乙醇(现用现配)洗涤磁珠,用移液器轻轻吹打3~5次(不要吹散磁珠)。磁力架上静置30sec后,用移液器小心吸弃上清。
- 重复此洗涤步骤一次。
- 将反应管置于磁力架上,打开离心管盖于室温条件下晾置5~10min或至磁珠干燥为止。
注:不要过分干燥磁珠,否则会造成得率降低。 - 将PCR管从磁力架中取出,加入22.5μL 10mM Tris-HCl (pH8.0)进行洗脱,使用移液器吹打充分混匀10次。室温静置5min后,置于磁力架上5min,待磁珠完全贴壁后,转移约20μL上清至新的离心管中。
- 将磁珠置于室温平衡20min。
- 上机测序前可使用凝胶电泳、qPCR定量或者Agilent生物分析仪对DNA文库质量进行鉴定。纯化后得到的DNA文库可保存于-20℃。
相关搜索:DNA文库构建试剂盒(illumina平台),DNA Library DirectFast Construction Kit(illumina)



